油菜抗咪唑啉酮类除草剂基因
A
咪唑啉酮类除草剂是目前应用较广泛的一类除草剂, 具有杀草谱广、用量低、除草效率高等优点, 深受广大农户喜爱[1]。研究表明, 乙酰羟基酸合酶(acetohydroxyacid synthase, AHAS), 也叫乙酰乳酸合酶(acetolactate synthase, ALS)是咪唑啉酮类除草剂的靶酶; 该除草剂通过与ALS形成复合物阻断底物进入酶活性位点通路, 抑制ALS活性, 导致支链氨基酸合成受阻, 使植物组织失绿、黄化, 最后逐渐死亡[2]。ALS负责催化2个平行反应, 催化两分子丙酮酸缩合形成2-乙酰乳酸放出CO2, 最终生成缬氨酸和亮氨酸, 催化一分子丙酮酸和一分子2-氧丁酸缩合形成乙酰羟基丁酸, 最终生成异亮氨酸[3]。对拟南芥、烟草、水稻、小麦、向日葵、大麦等抗性植物的分子机制研究表明, 抗性植物是由于体内ALS基因核酸序列产生若干碱基位点的变异, 造成编码蛋白氨基酸残基位点改变, 从而引起除草剂与ALS结合方式的变化[4,5,6,7]。
在油菜中, 加拿大Swanson等[8]采用小孢子化学诱变获得2个抗咪唑啉酮类除草剂的油菜突变体PM1和PM2[8]。PM1和PM2都由 ALS基因点突变而成, 其中PM1是基因 BnALS1的第653位Ser发生突变, PM2是基因 BnALS3的第574位Trp发生突变(以拟南芥的ALS氨基酸位置计算), 目前国外已商品化的抗咪唑啉酮油菜品种都是由这2个突变体转育而成[9]。2004年, 高建芹等[10,11]在油菜和大豆多年轮作的试验田中发现了1株抗咪唑啉酮油菜。通过连续多年自交及小孢子培养得到了抗性株系M9。抗性效应鉴定发现, M9抗除草剂的浓度是除草剂有效杀草浓度的2~3倍, 抗性稳定、具有极高的利用价值。胡茂龙等[12]从M9中克隆到抗性基因 BnALS1R发现, 抗性基因 BnALS1R与野生型基因 BnALS1存在1处SNP, 导致ASL1的第638位丝氨酸残基被天冬酰胺酸替代(以油菜的ALS1氨基酸位置计算), 这与PM1碱基突变位点相同。但M9为大豆田中发现的天然突变株后代系选材料, 该材料抗性是由除草剂诱发的自然突变获得, 这与向日葵抗性突变体IMISUN-1、IMISUN-2、RW-B获得的途径相同, 而与PM1、PM2抗性获得的途径不同[5,6,7]。国外抗性基因商业化利用需要交纳昂贵的专利费, 这将会提高油菜生产成本[12]。而我们发现的抗性基因 BnALS1R具有自主知识产权, 不受国际知识产权保护的限制, 若能进一步找到与之紧密连锁的分子标记, 从而进行标记辅助选择, 区分出育种材料中抗性基因的不同基因型, 则可指导田间选育, 加快育种进程。
等位基因特异PCR (allele-specific PCR, AS- PCR)是基于等位基因的SNP设计特异引物, 通过PCR扩增来检测样本基因型的一种鉴定方法[13]。该方法不受季节和时间限制, 具有快速、高效的优点, 已在水稻[14]和大麦[4]中成功运用。但迄今, 国内外关于检测甘蓝型油菜对咪唑啉酮类除草剂抗性基因的鲜见报道。前期研究发现, 突变体M9抗性基因 BnALS1R与正常敏感基因存在1处SNP差异, 用DNA测序技术可检测抗性基因, 但操作繁琐、费用相对昂贵。本研究依据SNP差异, 拟开发抗性基因位点的AS-PCR标记, 以期快速、准确检测抗性基因 BnALS1R,为利用抗性基因进行油菜抗除草剂分子标记辅助选择育种奠定基础。
油菜抗咪唑啉酮类除草剂突变体M9为浦惠明等[15]在油菜和大豆多年轮作的试验田中发现的天然突变体及后代单株M9-2、M9-3、M9-11和M9-14; 敏感野生型对照品种宁油12、宁油14、宁油16、宁油18和宁油20为江苏省审定品种; BnALS1R基因型分离群体所用的敏感型亲本3075R为江苏省农业科学院经济作物研究所选育的MICMS细胞质雄性不育双低恢复系。F2群体(3075R/M9-2)是以3075R为母本, M9-2为父本杂交、自交获得; BC1群体[(3075R/M9-2)/3075R]和BC2群体[(3075R/M9-2)/ M9-2]是由F1(3075R/M9-2)为母本, 分别与3075R、M9-2回交获得。190个抗咪唑啉酮MICMS纯合恢复系分别是由(3018R/M9)和(3075R/M9)的F1植株花粉经小孢子培养加倍获得的DH株系[12]。咪唑啉酮类除草剂为山东先达化工有限公司生产的5.0%“豆施乐”水剂。试验在本院油菜隔离繁殖区进行, 严格控制花粉外漂, 不对外界环境产生污染。
大肠杆菌 E. coliDH5α由农业部长江下游棉花与油菜重点实验室保存, DNA分子量标准、DNA回收试剂盒、质粒提取试剂盒均购自天根生化科技北京有限公司, 普通 Taq DNA聚合酶、dNTPs、PCR产物平末端加A试剂盒和IPTG均购自TaKaRa宝生物工程有限公司(中国大连), 高保真性DNA聚合酶KOD-Plus及PCR试剂购自东洋纺(上海)生物科技有限公司, 克隆载体pEASY-T1购自北京全式金生物技术有限公司。引物由上海Invitrogen生命技术有限公司合成, DNA测序由南京金斯瑞生物科技有限公司完成。
2007年油菜花期用M9株系的不同单株与MICMS双低恢复系3075R配制F1组合, 秋播鉴定F1和亲本的抗性表现。2008年春以F1自交获得F2世代, 同时用相应的抗性亲本和敏感型亲本分别对以敏感型亲本为母本的反交组合F1回交, 获得BC1、BC2群体, 秋播鉴定分离世代F2、BC1、BC2的抗性表现。在油菜三至五叶期用浓度为90 ga.i. hm-2除草剂处理, 处理前取少许叶片保存于-80℃冰箱, 用于DNA提取。20 d后调查成活苗与死苗数, 统计分离比例, 进行卡方测验。采用CTAB法并稍作修改提取DNA[16], 用1%( V/W)的琼脂糖电泳和分光光度法检测其纯度。
此前研究发现, M9与常规油菜宁油16、宁油18编码ALS家族中 BnALS1的核苷酸序列存在1处SNP[12], 根据该处SNP可开发AS-PCR标记检测抗性基因 BnALS1R。但由于油菜ALS基因家族核酸序列的高度同源性, 特别是 BnALS1和 BnALS3在核酸水平的同源性达98%[17], 使得在编码区内很难开发出引物分别特异扩增 BnALS1和 BnALS3的基因片段。为此首先必须找到这2个基因在M9、宁油16、宁油18的序列差异, 通过比较 BnALS1和 BnALS3的序列差异, 设计特异引物扩增 BnALS1基因序列片段, 排除 BnALS3基因序列对检测抗性基因的干扰。由于此前申请的专利中已经获得M9、宁油16、宁油18的 BnALS1全长编码序列( BnALS1-NY16、 BnALS1-NY18)[18], 因此为获得M9、宁油16、宁油18的 BnALS3全长编码序列, 根据NCBI中 BnALS3基因序列(GenBank登录号为Z11526), 利用Primer Premier 5.0软件在基因编码区段两侧且与 BnALS1的非同源区设计特异正向引物BnALS3-F: 5'-CGC GGTACCCTCTCTCTCTCTCATCTAACCAT-3'和反向引物BnALS3-R: 5'-CGCACTAGTCTCTCAGTAC TTAGTGCGACC-3', 通过PCR扩增全长的 BnALS3基因。PCR体系含DNA模板1 μL、10×酶反应缓冲液2 μL、25 mmol L-1 MgSO4 1.2 μL、2 mmol L-1 dNTPs 2 μL、10 μmol L-1引物各2 μL、1 U L-1KOD-Plus Taq酶0.8 μL, 加水至20 μL。反应程序为94℃预变性5 min, 94℃变性30 s, 55℃退火30 s, 72℃延伸2.5 min, 35个循环。按试剂盒使用说明书进行PCR产物平末端加A后, 经1.2% ( V/W)琼脂糖凝胶电泳分离, 用DNA凝胶回收试剂盒将目的片段回收纯化, 连接于克隆载体pEASY-T1上, 热激转化DH5α。通过蓝白斑筛选和菌落PCR鉴定, 将阳性克隆送公司测序。通过DNAMAN6.0、Sequencher、DNASTAR等软件分析野生型与突变体 BnALS1、 BnALS3基因序列的差异。根据序列差异, 设计30条分子标记引物(表1)。其中每条等位基因特异PCR引物的3末端分别与SNP位点对应的等位碱基完全匹配, 同时在特异引物3末端的倒数第3或第4位置引入1个错配碱基, 每个位置引入3种错配碱基,以期获得多个多态性标记。等位基因特异PCR引物AP3F~AP14F分别与3条公用引物AP1R、AP2R、A5R配对, 公用引物AP15F~AP17F分别与等位基因特异PCR引物AP18R~AP29R配对。以提取的油菜基因组DNA为模板, PCR筛选36个组合分子标记引物扩增产物多态性。理论上, 若样品中的等位位点与等位基因特异PCR引物的3末端相匹配, 便能进行有效扩增, 反之则不能进行有效扩增。
| 表1 检测抗性基因的AS-PCR引物序列 Table 1 AS-PCR primer for assay of herbicide-resistant gene |
PCR反应体系含: 10 ng μL-1 DNA模板2.0 μL, 10 μmol L-1引物的各2. 0 μL, 10×酶反应缓冲液2 μL, 25 mmol L-1 MgC12 1.2 μL, 2.5 mmol L-1dNTPs 1.6 μL, 5 U L-1 Taq酶0.1 μL, 加水至20 μL; PCR反应程序为94oC预变性5 min, 94℃变性30 s, 60℃退火 30 s, 72℃延伸1 min, 共35个循环; 然后72℃延伸5 min, 12℃冷却10 min后, 将扩增产物加上样缓冲液终止反应。扩增产物在质量比浓度为1.2%的琼脂糖凝胶上电泳, 经溴化乙锭染色并于凝胶成像系统下观察、记载。用筛选的多态性标记引物在抗性油菜和敏感野生型品种中克隆, PCR产物测序。
为探明多态性标记对甘蓝型油菜抗咪唑啉酮基因 BnALS1R基因型的检测效果, 提取油菜苗期3个 BnALS1R基因型分离群体植株叶片DNA, 利用多态性标记引物进行PCR扩增。DNA提取、PCR反应、产物检测方法同上。统计基因型分离比例, 进行卡平方测验。
于苗期提取抗咪唑啉酮MICMS纯合恢复系的DNA, 利用多态性标记引物进行PCR扩增, 检测抗性恢复系中抗性基因 BnALS1R是否存在。DNA提取、PCR反应、产物检测方法同上。
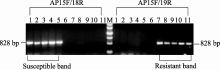
为消除 BnALS3基因序列对特异性检测抗性基因 BnASL1R的干扰, 首先扩增M9及野生型宁油16、宁油18的 BnALS3基因, PCR产物与预期大小相同。测序发现, 3个序列与NCBI上公布的 BnALS3基因序列Z11526同源性达99%, 表明成功克隆到3个材料的 BnALS3基因, 分别命名为 BnALS3-M9、 BnALS3-NY16、 BnALS3-NY18。将3个基因序列与之前获得专利的 BnALS1的3个基因序列及Z11524、Z11526比对发现, 3个材料的 BnALS1和 BnALS3基因编码区的DNA序列高度同源, 仅存在1处9个碱基插入/缺失和一些单核甘酸变异(图1)。而9个碱基插入/缺失主要是重复序列, 不适合作为引物序列。因此, 根据此前专利中发现的突变体M9与宁油16、宁油18的 BnALS1核苷酸序列存在的单碱基突变(G/A), 将引物序列锚定在 BnALS1与 BnALS3单核甘酸变异上, 共设计30条AS-PCR引物(表1)。筛选36个组合AS-PCR标记多态性, 结果获得AP15F/AP18R、AP15F/AP19能分别特异扩增敏感基因 BnALS1、抗性基因 BnALS1R, 这3条引物在基因序列上位置如图1所示。引物对AP15F/AP18R特异扩增的是 BnALS1位点上第1933处核苷酸为G的等位位点, 即未突变的油菜野生型 BnALS1基因, 对除草剂敏感; 引物对AP15F/AP19R特异扩增的是 BnALS1位点上第1933处核苷酸为A的等位位点, 即抗性基因 BnALS1R, 对除草剂具有抗性。
用上述2对引物对含敏感基因 BnALS1的常规油菜宁油12、宁油14、宁油16、宁油18、宁油20与含有抗性基因 BnALS1R的抗咪唑啉酮油菜M9、M9-2、M9-3、M9-11、M9-14为模板进行PCR扩增。结果表明, 所有常规油菜由引物对AP15F/AP18R扩增的产物均有828 bp特征条带, 而AP15F/AP19无特征条带。反之, 所有抗性油菜AP15F/AP18R扩增产物无特征条带而AP15F/AP19R均有828 bp特征条带(图2)。特征条带经测序表明, PCR产物属于油菜 BnALS1的基因片段而非其他非特异性扩增, 且在抗性油菜与常规油菜中存在单碱基突变G/A (图3)。田间苗期喷施除草剂表明, 未发现抗性油菜死苗, 而5个常规油菜喷药后20 d全部死亡。以上结果表明, 用2对引物多态性分子标记可以准确检测油菜种质资源中是否含有抗咪唑啉酮基因 BnALS1R。
利用2对多态性标记在对3个分离群体F2、BC1和BC2中的 BnALS1R基因型检测发现, F2群体呈现3种特征条带(图4), 即不含抗性基因MICMS双低恢复系3075R特征条带(引物对AP15F/AP18R扩增产物有特征条带828 bp而AP15F/AP19无特征条带)为纯合敏感基因型单株, 如单株6、11、14、17、20; 含有抗性基因的M9-2特征条带(引物对AP15F/AP18R扩增产物无特征条带而AP15F/ AP19R有特征条带828 bp)为纯合抗性基因型单株, 如单株10、12、16、24; 同时具有双亲杂合带型(引物对AP15F/AP18R 和AP15F/AP19扩增产物都有特征条带828 bp)为杂合抗性基因型单株, 如单株4、5、7~9、13、15、18、19、21~23。在F2群体中检测154个单株, 纯合敏感基因型单株35个, 纯合抗性基因型单株39个, 而具有杂合抗性基因型单株80个, 3种基因型数量符合1∶2∶1 (表2)。BC1群体中检测的227个单株呈现2种条带(图5)。其中纯合敏感基因型单株共110个, 如单株5、9~10、12、14~15、19~20、23, 杂合抗性基因型单株117个, 如单株4、6~8、11、13、16~18、21~22、24, 2种基因型数量符合1∶1 (表2)。BC2群体中检测的201个单株同样呈现2种条带(图6), 其中纯合抗性基因型单株113个(图6), 如单株4、6~7、9、12~13、16~17、21~22、24, 杂合抗性基因型单株98个, 如单株5、8、10~11、14~15、18~20、23, 2种基因型数量符合1∶1 (表2)。以上3个群体PCR检测结果与苗期喷施除草剂鉴定结果完全一致, 基因型分离比均遵循单基因遗传规律。因此, 2对引物的多态性标记可有效检测油菜抗咪唑啉酮基因 BnALS1R的3种基因型。
 | 图4 AS-PCR引物在F2群体中PCR扩增结果M: DNA分子量标准(同图2); 1: 3075R; 2: F1(3075R×M9-2); 3: M9-2; 4~24: 部分F2单株。Fig. 4 PCR products obtained using AS-PCR primers among F2 population in rapeseedM: DNA marker (same as Fig. 2); 1: 3075R; 2: 3075R×M9-2 F1; 3: M9-2; 4~24: plants randomly selected from F2 population. |
 | 图5 AS-PCR引物在BC1群体中PCR扩增结果M: DNA分子量标准(同图2); 1: 3075R; 2: M9-2; 3: F1(3075R×M9-2); 4~24: 部分BC1单株。Fig. 5 PCR products obtained using AS-PCR primers among BC1 population in rapeseedM: DNA marker (same as Fig.2); 1: 3075R; 2: M9-2; 3: 3075R×M9-2 F1; 4-24: plants randomly selected from BC1 population. |
| 表2 SNP位点在F2、BC1、BC2群体中的基因型分离 Table 2 Genotype frequencies at SNP site in F2, BC1, and BC2 populations |
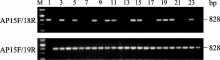
在此前的研究中, 我们已获得190个携带抗性基因 BnALS1R的MICMS纯合恢复系。为验证筛选的多态性标记AP15F/AP18R、AP15F/AP19R对抗性基因 BnALS1R的检测效果, 对获得的抗咪唑啉酮纯合恢复系进行2次PCR扩增, 电泳结果表明, 所有抗性恢复系中都含有抗性基因 BnALS1R特征条带(图7), 进一步证明2对引物多态性标记检测抗性基因的准确性。
基于基因序列SNP开发分子标记的方法很多, 如RFLP、CAPS或dCAPS等传统方法[19,20,21]。本研究利用抗性油菜M9携带的抗性基因 BnALS1R与野生型基因的SNP差异, 在油菜 BnALS1与 BnALS3序列的非同源区设计30条标记引物, 从中筛选出3条引物的AS-PCR标记。与传统标记相比, 该方法不需要繁琐的分子杂交和限制性酶切实验, 仅需通过2次PCR反应就可鉴定出甘蓝型油菜抗除草剂基因 BnALS1R及其基因型。方法高效、快捷、价格低廉, 只要具有PCR仪及相关电泳设备的实验室就能完成。
与一般农艺性状连锁的分子标记不同, 本研究获得的标记是根据基因突变位点设计的功能性标记, 能直接反映植株的抗性, 不存在由于遗传交换而造成的错误鉴定。因此, 利用该标记方法能有效用于抗咪唑啉酮基因 BnALS1R引起的油菜对咪唑啉酮类除草剂抗性的标记辅助育种。常规育种方法是利用含 BnALS1R基因的M9与生产上推广的主栽品种进行一系列杂交, 然后在每个分离后代中喷施除草剂进行鉴定, 最终选择含抗咪唑啉酮基因 BnALS1R的抗性单株。在每个分离后代除草剂鉴定过程中, 如果除草剂剂量使用不当或喷施不均匀极易导致误选。另外, 多年连续喷施过量的咪唑啉酮类除草剂可能会导致土壤残留, 对下茬作物有一定影响。有时在抗除草剂基因研究过程中需要保存不抗的材料, 用作比较研究。因此, 利用 BnALS1R基因的功能性标记检测植株DNA, 可以在油菜任何时期鉴定出抗性基因的纯合基因型单株以及优良性状的不抗单株, 淘汰其他单株, 这样不仅节约育种成本、减少土壤残留, 而且可大大加速抗咪唑啉酮油菜品种的选择进程。
甘蓝型油菜为白菜型油菜和甘蓝天然杂交自然加倍而来, 包括A、C两套基因组, 其中A基因组起源于白菜型油菜, C基因组起源于甘蓝。基因组进化过程中高度重排导致甘蓝型油菜相关基因多以基因家族的形式存在[22]。家族内基因核酸序列高度同源, 咪唑啉酮类除草剂的靶基因ALS也不例外。A、C基因组内3个具有功能的ALS基因核酸序列高度同源[23], 特别是 BnALS1和 BnALS3在核酸水平的同源性达98%, 这给AS-PCR标记检测 BnALS1增加了难度, 因为在进行PCR扩增油菜 BnALS1过程中会受到高度同源序列 BnALS3的干扰。本研究中使用的30条引物组合成36对AS-PCR标记, 仅筛选出1个组合在抗性油菜和常规油菜间具有多态性, 而其他组合虽然都能有效扩增但无多态性, 可能是由于同源序列 BnALS3的干扰。另外一个原因可能来自AS-PCR引物的自身设计特点, 因为在设计AS-PCR引物时, 不管将公用引物设计成正向引物或者是反向引物, 其他2条等位基因特异PCR引物的3末端都必须锚定在SNP位点上, 即使在AS引物3末端倒数第3或第4位置人为引入1个特定的错配碱基, 降低AS-PCR引物与非匹配模板结合, 也很难保证在多倍体中每条引物均具有很好的PCR特异性[24]。同时研究中发现, 开发甘蓝型油菜AS-PCR标记时公用引物序列的特异性非常重要。本研究筛选的多态性AS-PCR标记公用引物AP15F恰好锚定在 BnALS1和 BnALS3的4个SNP上(图1), 其分别与等位基因引物AP18R、19R配对才能准确鉴定抗性基因型。反之, 换成公用引物AP16F、AP17F, 则达不到鉴定效果。推测是由于AP16F、AP17F仅锚定在 BnALS1和 BnALS3的2个SNP上, 特异性较差。研究中还发现, 当使用共同公用引物AP15F时, AS引物3-末端引入错配碱基的替换方式和位置也尤为关键。因为仅在3末端倒数第3位引入错配碱基时, 3种碱基替换方式中的C/A类型替换才具有引物特异性。反之, 在倒数第4位引入错配碱基时, 任何1种碱基替换方式的AS引物都不具有引物特异性。Hayashi等[25]在水稻中也发现, AS引物在3末端倒数第3位引入C/A类型的替换能显著提高引物的特异性, 他对49个SNP位点设计了特异引物, 其中67%的引物能可靠地区分2个等位基因。卫波等[24]认为错配碱基的位置及替换方式对PCR结果的影响可能与3末端不同错配碱基产生的碱基堆积力、氢键及其立体结构的稳定性有关。还可能与错配碱基对和DNA聚合酶之间的相互作用造成的空间位阻有关。因此, AS引物3末端能否与其互补模板特异扩增而不与其非互补模板扩增的特性是人工引入错配碱基与等位基因3末端固有的SNP错配碱基共同作用的结果。
Kadaru等[14]在水稻、Lee等[4]在大麦中也都获得了检测抗咪唑啉酮基因的AS-PCR标记, 但与水稻染色体组(2 n=24)和大麦(2 n=14)不同, 甘蓝型油菜为异源四倍体(2 n=38), 基因组庞大, 重复序列较多。因此, 为明确研究获得的引物对AP15F/18R、AP15F/19R特异扩增的是油菜 BnALS1基因片段而非其他非特异扩增, 我们对2对引物分别在常规油菜和抗性油菜扩增的条带进行了测序, 结果表明特异扩增的是 BnALS1基因片段, 且在常规油菜和抗性油菜之间存在单碱基突变。同时, 用该引物组合对3个群体进行扩增, 发现基因型分离比遵循单基因遗传模式, 证明该AS-PCR分子标记可以有效、准确检测油菜抗咪唑啉酮基因 BnALS1R的3种不同基因型。另外, 陈吉宝等[26]根据普通小麦( Triticum aestivum L.)品种旱选10和鲁麦14之间在 TaDREB1基因的SNP进行AS-PCR标记研究, 获得了1对AS-PCR标记可以区分2个品种, 并用该标记引物将 TaDREB1基因定位于3BS, 表明AS-PCR标记可以用在诸如油菜、小麦等多倍体作物中。当然, 利用本研究的标记定位油菜 BnALS1R的工作正在进 行中。
抗咪唑啉酮类除草剂油菜已在加拿大、澳大利亚、欧洲国家广泛种植, 但我国由于缺乏自主知识产权的抗除草剂基因一直无法商业化应用[27,28]。前期研究, 我们从油菜自然突变的抗性材料M9中克隆获得了抗性基因 BnALS1R, 虽然该基因的碱基突变位点与加拿大PM1突变位点相同, 但 BnALS1R是我国拥有自主知识产权的抗除草剂基因, 不受国际知识产权保护的限制, 也是国内首次报道的抗咪唑啉酮类除草剂基因[12]。同时, 本研究根据该突变位点的SNP, 在国内外首次开发了检测该抗性基因的分子标记, 并在抗性恢复系中进行了检测, 发现该AS-PCR标记能特异扩增出抗性基因的目的条带, 表明基于此标记的PCR检测方法精确、可靠。显然, 以上这些研究为我国抗咪唑啉酮油菜的选育提供了基因来源和功能标记。
从30条等位基因特异PCR引物中筛选、鉴定出3条AS-PCR引物, 通过2次PCR就可以快速、准确检测出油菜品种或品系中咪唑啉酮类除草剂抗性基因 BnALS1R的基因型。该AS-PCR标记的获得为利用抗性基因进行油菜抗除草剂分子标记辅助选择育种奠定了基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|